Parlare o scrivere di sali che intaccano le murature non è semplice la letteratura in questo particolare comparto di
degrado edilizio è molto ampia almeno per gli esperti del settore.
È quasi naturale che un immobile abbia dei difetti soprattutto per quegli edifici datati. Ciò è dovuto al fatto che nessun
edificio è esente da manutenzione, in particolare per quegli immobili che hanno attraversato secoli. I difetti possono
anche essere il risultato di una costruzione errata, di una scarsa fattura, alla mancanza di una corretta pratica edilizia,
alla mancanza o alla manutenzione errata e ad altri fattori. Oltre ai fattori sopra indicati, ci sono diversi fattori che
contribuiscono ai difetti di costruzione, inclusi fattori esterni, agenti biologici e materiale da costruzione stesso. Fattori
esterni come aria, luce solare, umidità, contaminazione gassosa, suolo e così via. Ma oggi parliamo dei Sali.
I principali tipi di sali igroscopici che interessano un manufatto edilizio, per semplicità, possono essere riassunti in tre
gruppi:
1. gruppo dei solfati;
2. gruppo dei nitrati;
3. gruppo dei cloruri.
Il gruppo dei solfati è il gruppo più importante ed il più frequente. I solfati sono i sali dell’acido solforico e sono
presenti sulla crosta terrestre in tutti i materiali da costruzione. Questi sali, allo stato latente, sono per lo più non
igroscopici, ma possono comunque assorbire acqua in grande quantità. Oltre ad essere già presenti nel materiale da
costruzione, i solfati possono essere introdotti all’interno di una muratura, dall’umidità di risalita e di permeazione per
via capillare; risalgono poi nella struttura muraria sempre grazie al veicolo acquoso, depositandosi e concentrandosi
nello strato sub-superficiale delle pareti, non più in soluzione, durante la fase di evaporazione dell’umidità
nell’ambiente esterno. I solfati, sotto forma di acido solforico, possono interessare superficialmente una struttura, in
quanto trasportati sempre in soluzione dal vapore acqueo dell’aria e/o dalla pioggia battente (piogge acide). La maggior
parte dei danni che subiscono i materiali da costruzione sono causati dai solfati dell’acido solforico. Questi danni sono
individuabili, come detto in precedenza, nella decoesione del materiale, e cioè corrosione superficiale sotto forma di
“sabbia” o sfaldamento stratificato. I solfati (sodio, potassio, magnesio, calcio, ferro) sono sali molto comuni, la crosta
terrestre ne è composta per il 6% e si trovano quindi comunemente nei materiali da costruzione, sono molto igroscopici
e solubili, cambiano facilmente stato fisico, e l’aumento di volume comporta aumento di tensione nella muratura che si
disgrega rapidamente.
Il gruppo dei nitrati è il gruppo che annovera più sali di natura igroscopica, ad eccezione del nitrato di potassio. I nitrati
si possono trovare nel suolo e nel sottosuolo in grandissime quantità. Come gruppo sono i più solubili di tutti i sali
metallici. Non sono molto presente in origine nel materiale da costruzione, ma vengono trasportati in massa, allo stato
solubile dall’umidità di risalita e di permeazione per via capillare. Una minima parte di nitrati, sotto forma di acido
nitroso e nitrico, derivanti dall’uso massiccio di fertilizzanti in determinate zone, possono essere contenuti in globuli di
vapore e depositati, ad avvenuta condensazione, nello strato superficiale dei manufatti. Si riscontra una notevole
presenza di nitrati allo stato latente, nelle zone rurali in prossimità delle stalle, vicino concimaie e/o pozzi neri difettosi,
ecc. La presenza di nitrati è senza dubbio attribuibile alle soluzioni sanitarie, dalla perdita di scarico delle fognature. I
danni causati dai nitrati al materiale da costruzione, in quanto altamente igroscopici, sono del tipo di quelli causati dai
solfati, ma in modo ancor più accentuato. I nitrati (sodio, potassio, magnesio, calcio) sono di origine organica, si
trovano comunemente nei terreni di campagna, nei locali come le stalle, nelle costruzioni rurali, nei luoghi adibiti a
sepolture o che hanno subito massicci bombardamenti. Sono molto devastanti e non è semplice rilevarli senza un’analisi
di laboratorio se non con un’attenta ed esperta osservazione. Cristallizzano con umidità relativa del 50% o inferiore.
Il gruppo dei cloruri è particolarmente presente nelle aree costiere. Vengono generalmente trasportati all’interno di una
muratura per il fenomeno dell’umidità di risalita e di permeazione per via capillare. Nello strato superficiale delle
strutture, i cloruri, sotto forma di cloruro sodico, vengono trasportati in globuli di vapore acqueo, che a contatto con le
superfici, condensa; il passaggio allo strato sub-superficiale avviene senza difficoltà. I manufatti costieri possono essere
interessati da cloruri trasportati dai venti marini. Allo stato naturale i cloruri non sono igroscopici; lo diventeranno però
quando si combinano con altri sali, soprattutto i solfati; i cloruri comunque, anche se combinati, non sono in grado di
assorbire grandi quantità d’acqua. Non creano grossi danni al materiale da costruzione. I cloruri (sodio, potassio,
magnesio, calcio) si riconoscono per la formazione di piccoli cristalli biancastri, sono molto igroscopici e a 25°C
cristallizzano con umidità atmosferica vicina al 30% rendendo difficile l’asciugatura del muro, che per questo motivo
può subire degradi da aggressione biologica aggravandone la patologia.
Le fonti dei sali
Le fonti di sali nelle pareti sono terreni salini e acque sotterranee, aerosol marini costituito principalmente da sale,
spazzato in aria da forti venti nelle vicinanze di siti costieri, sali aerodispersi, inquinanti atmosferici, fertilizzanti
inorganici da giardino, fonti biologiche rottura dei tubi fognari o come escrementi di piccione, sale naturalmente
presente nella pietra, laterizio o malta sabbia, acqua salata utilizzata per preparare l’argilla o per miscelare malte e
composti detergenti che contengono o reagiscono per produrre sali nelle pareti. Nella fig. 1 vediamo come i sali
veicolano all’interno della muratura
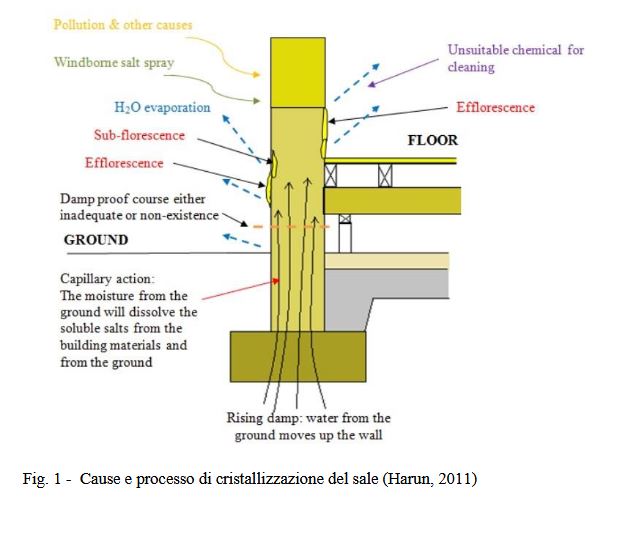
L’ umidità di risalita fonte di trasporto dei sali
È evidente che se si parla di sali nelle murature non si può non parlare di risalita. L’umidità di risalita e tra le maggiori
cause del trasporto dei Sali verso la parte del bagnasciuga di una muratura. Di per sé, l’umidità di risalita provoca muri
bagnati e odori di muffa, ma un limitato decadimento delle murature (tranne che per materiali particolarmente sensibili,
come quelli contenenti argille rigonfianti – alcuni materiali terrosi e alcuni arenarie e calcari ricchi di argilla). È quando
il sale è presente nel terreno che l’attacco salino si combina con l’umidità di risalita per causare un sostanziale
decadimento. In pratica è probabile che un po’ di sale sia associato alla maggior parte dei casi di umidità di risalita, in
particolare negli edifici più vecchi che hanno accumulato sali per un lungo periodo di tempo.
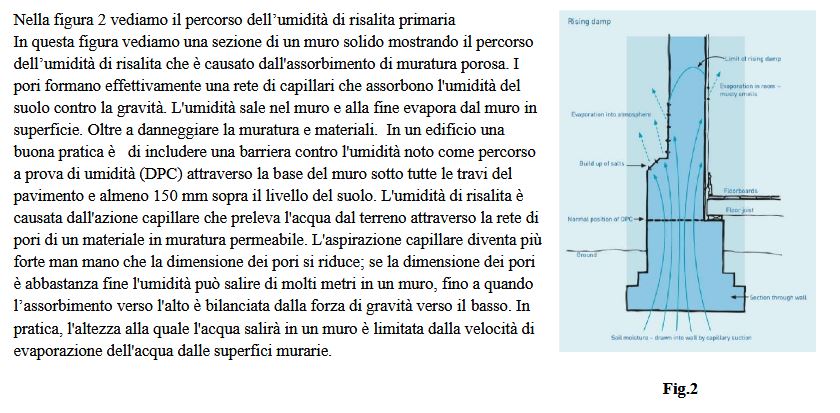
Il tasso di evaporazione per superfici esterne è legato alla natura dei materiali in muratura, superficie rivestimenti,
clima, stagione e ubicazione. Pertanto, può essere che un vecchio edificio con DPC (taglia muro) carenti, assenti o che
sia gravemente danneggiato, nonostante la salinità relativamente bassa nel terreno sottostante. Una volta che l’umidità di
risalita ha attirato abbastanza sale nel muro in modo che la concentrazione di sale nella muratura sia maggiore che nel
terreno sottostante, la stessa presenza dei sali aiuta a perpetuare l’umidità, aumentando il problema. Ciò è dovuto alla
natura igroscopica e deliquescente di molti sali: la loro tendenza ad attirare l’acqua per poi dissolversi in essa. La
deliquescenza mantiene le pareti saline umide con tempo umido e quindi l’aspirazione del soluto (la pressione osmotica
di una soluzione salina) attira più acqua verso la maggiore concentrazione di sali, aggravando l’aspirazione capillare e
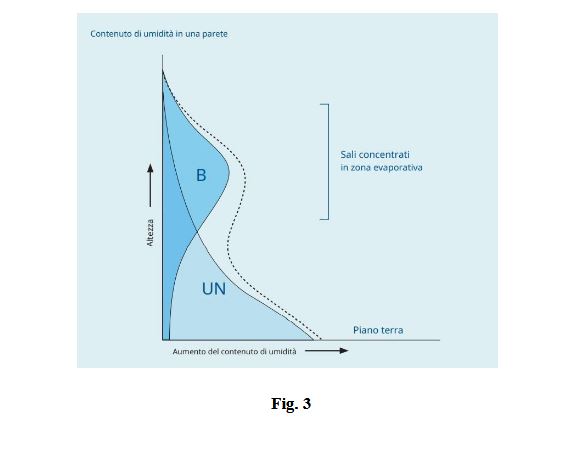
aggiungendosi all’umidità di risalita. Nella figura 3 sotto vediamo il contenuto di umidità in una parete in muratura
dovuto ad A, azione capillare (umidità di risalita) e B, sali igroscopici. Il contenuto di umidità totale è indicato dalla
linea tratteggiata ed è la somma di A e B. I contributi relativi di A e B al totale dipenderanno dalla quantità e natura dei
sali nei suoli sottostanti, dal clima (umidità, temperatura e velocità del vento) e puntuale (più il muro è vecchio, più
tempo avrà dovuto accumulare sale)

La cristallizzazione del sale porterà a lavori di intonacatura distruttivi come peeling, scheggiatura e sfaldamento dei
lavori di intonacatura. Anche le finiture delle pareti come la pittura saranno interessate. Nel tempo, i sali migrano nei
materiali porosi e iniziano a ostruire gli spazi dei pori. Il ciclo di cristallizzazione e idratazione portano i pori a saturarsi.
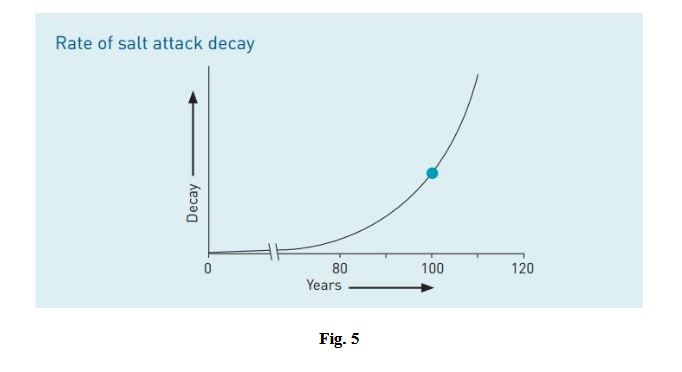
Questo processo porterà all’imposizione di un notevole stress sui pori e di conseguenza sulle pareti. Il tasso di
decadimento dell’attacco del sale di un edificio segue una curva esponenziale in cui c’è un lungo periodo prima di
iniziare a decadere mentre il sale si accumula lentamente nei pori della muratura. Poi quando il sale ha riempito i pori
c’è una rapida accelerazione del decadimento, la condizione di degrado per un edificio di 100 anni può essere
raddoppiato dopo solo altri 10 anni. Si è tentati di pensare che poiché la casa è durata 100 anni, il decadimento che farà
non sarà molto peggio dopo altri 20 o 30 anni. Rimandare l’azione su questa base sarebbe sbagliata, come mostra il
grafico. Il grafico è basato sulla scienza della conservazione e una lettura del tasso di decadimento dei materiali. C’è un
lungo periodo di quasi nessun decadimento (in questo caso circa 80 anni) durante il quale i sali si accumulano
lentamente all’interno della muratura, quando poi riempiono i pori tanto da causare un significativo decadimento
dell’attacco del sale. Quando la casa compie cento anni, il decadimento è accelerato fino ad avvicinarsi al suo tasso
massimo (la curva della linea), e in soli dieci anni il decadimento sarà due volte più grave di adesso. Come possiamo
vedere nella figura 5.
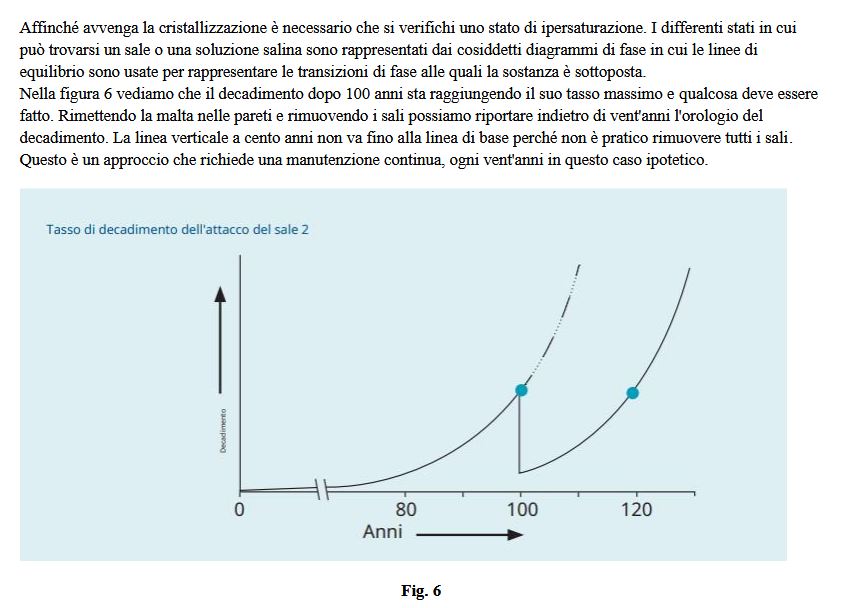
Conformazione dei cristalli salini
Su un substrato in essiccamento, le efflorescenze sono generate con una sequenza di morfologie dipendente dalle
variazioni delle proprietà di imbibizione del substrato e dalla ventilazione dello stesso (Fig. 7).
In un substrato umido, finché i cristalli sono immersi in un film di soluzione, essi assumono dimensioni notevoli, con
tipiche forme di equilibrio (Fig. 7 a). Con la riduzione del film della soluzione, l’aggregato cristallino diventa una crosta
granulare formata da cristalli più piccoli e isometrici (Fig. 7 b) e diventa sempre più fibrosa al diminuire dello spessore
del film di soluzione (Fig. 7 c). Quando il supporto è leggermente umido crescono cristalli colonnari e whiskers (sotto
forma di sottilissimi aghi) (Fig. 7 d); infine cristalli molto sottili si accrescono quando le superfici sono quasi secche
(Fig. 7 e).
a) Grandi cristalli con le loro specifiche forme di equilibrio si sviluppano quando sono completamente immersi in una
pellicola di soluzione su un substrato bagnato. b) Una crosta granulare formata da più piccoli e isometrici cristalli cresce
su un substrato bagnato con ridotto film di soluzione. c) Una crosta fibrosa cresce in aria da un substrato coperto da un
sottilissimo film di soluzione. d) Cristalli colonnari e whiskers crescono quando il supporto è leggermente umido. e)
cristalli molto sottili crescono in aria dalla superficie quasi a secca.
La cristallizzazione può non avvenire immediatamente perché la soluzione può soprassaturarsi, cioè raggiunge uno stato
di non equilibrio in cui una maggiore quantità di sali è disciolta rispetto a quella che potrebbe essere contenuta nella
soluzione in condizioni di equilibrio. Maggiore è la soprassaturazione maggiore è la tendenza del sale a cristallizzare
velocemente. La massima soprassaturazione che la soluzione salina può raggiungere in determinate condizioni è
chiamata limite metastabile. Ogni fase salina ha un campo di stabilità definito da un certo intervallo di temperatura e
pressione parziale al vapor d’acqua, al di fuori del quale può continuare ad esistere ma diventa metastabile. Una fase
metastabile ha bisogno di un’opportuna sollecitazione dall’esterno per cominciare a trasformarsi nella corrispettiva fase
stabile. Ad esempio, la presenza o meno di germi di cristallizzazione può influenzare fortemente la capacità della
soluzione salina di soprassaturare. In oltre il grado di soprassaturazione è in grado di influenzare la velocità di
nucleazione e crescita dei cristalli. Ad un basso grado la nucleazione è praticamente inibita del tutto e possono crescere
solo eventuali germi cristallini già presenti. Si ottengono alla fine precipitati grossolani. All’aumentare del grado di
soprassaturazione la velocità di nucleazione aumenta rapidamente e quando è maggiore della velocità di crescita dei
cristalli si hanno precipitati molto fini e veloci. Un esempio di struttura cristallina che possiamo trovare sono i cristalli a
tramoggia o hopper crystal di alite o salgemma. I bordi dei cristalli a tramoggia sono pienamente sviluppati, ma gli
spazi interni non sono riempiti. Questo perché il cristallo stava crescendo così rapidamente che non c’era abbastanza
tempo (o materiale) per riempire i vuoti. I bordi interni mostrano ancora la struttura cristallina classica del minerale e
così sembrano una serie di versioni sempre più ridotte del cristallo originale.
Condizioni per la precipitazione e cristallizzazione dei sali solubili
La precipitazione di sali può essere dovuta a tre diversi meccanismi:
1) Per reazione chimica
2) Per evaporazione di una soluzione acquosa
3) Per reazione igroscopica con l’aria umida
Quando un sale cristallizza in una soluzione acquosa, la precipitazione è controllata da una serie di relazioni:

L’acqua penetrata nelle murature, però, tende a dirigersi verso le superfici esterne, dove può evaporare più facilmente.
Raggiunta la superficie esterna avviene l’evaporazione dell’acqua e la conseguente cristallizzazione dei sali
(efflorescenze, sub efflorescenze). Il processo è continuo e cumulativo perché dalla muratura evapora acqua
praticamente distillata per cui i prodotti salini rimangono inglobati nelle porosità più superficiali del materiale e, proprio
per questo meccanismo di formazione, continuano ad aumentare secondo criteri chiaramente cumulativi. Nel tempo, se
l’effetto non si arresta, ed in particolare in murature antiche già soggette ad altre forme di aggressione, le alterazioni
fisico-chimiche prodotte dalle efflorescenze possono contribuire a compromettere l’efficienza statica degli elementi
interessati Si ha, quindi, un aumento delle pressioni interne che molto spesso può portare al distacco dello strato più
esterno di materiale oppure al graduale sbriciolamento della parte interna del muro con aumento della porosità specifica
(stress meccanico).
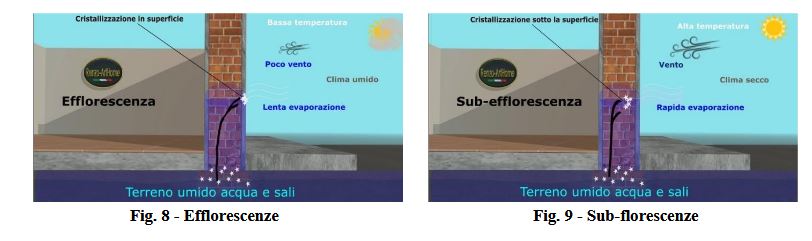
In zone poco ventilate, la velocità di evaporazione dell’acqua dalla soluzione risulta minore della velocità di trasporto
della soluzione attraverso i pori del materiale, per cui gli ioni vengono trascinati fuori dalla matrice dando così origine
ad una cristallizzazione esterna nota come “efflorescenza”, manifestazione dal punto di vista estetico non certamente
gradevole, ma facilmente eliminabile, ad esempio, con la semplice spazzolatura della superficie.
Ben più gravi possono essere le conseguenze se, per contro, la struttura risulta esposta a forte ventilazione; in questo
caso la velocità di evaporazione è maggiore della velocità di trasporto della soluzione ed il sale cristallizza all’interno
della matrice porosa dando origine a “sub-florescenze”, non visibili, ma certamente molto più pericolose delle
“efflorescenze”. Per quel che riguarda la porosità, più che del volume totale di vuoti presenti, è importante in questo
contesto tenere conto della loro distribuzione dimensionale. Secondo l’approccio termodinamico di Everett (spesso
usato per calcolare le pressioni che si determinano all’interno di una matrice porosa in seguito alla transizione liquido-
solido dell’acqua), la pressione Pr che si sviluppa in seguito alla cristallizzazione di un sale di tensione interfacciale g in
un sistema poroso idealizzato con due classi di pori comunicanti di raggio r ed R (con R>r) è data dalla relazione:
Pr = 2 g (1/r – 1/R) [ 1] ed ipotizzando R >> r, la [ 1] diventa: Pr ~ 2 g 1/r [ 2]
La pressione di cristallizzazione, quindi, sarà tanto maggiore quanto più piccolo sarà il raggio medio dei pori e quanto
maggiore sarà la tensione interfacciale g.
Le sollecitazioni indotte all’interno dei materiali dipendono quindi sia dalla natura del sale (attraverso g), sia dalle
caratteristiche chimiche e strutturali del materiale, che potrà o meno resistere in dipendenza delle sue caratteristiche
meccaniche.
I Sali e l’attrazione elettrostatica
I sali sono costituiti da una combinazione di ioni caricati positivamente e negativamente noti come cationi e anioni. I
cationi comunemente incontrati nelle pareti sono il Sodio (Na+), Potassio (K+), Magnesio (Mg2+) e calcio (ca2+). Gli
anioni comunemente nelle pareti sono Cloruro (Cl-), solfato (SO2- 2- 4), Nitrato (N2- 3) e Carbonato (CO 3).
ll legame ionico è un’attrazione elettrostatica che si verifica per trasferimento di elettroni quando due atomi hanno una
grande differenza di elettronegatività. L’atomo che acquisisce elettroni ottiene cariche negative, diventando uno ione
negativo (anione), l’atomo che trasferisce elettroni ottiene cariche positive, diventando ione positivo (catione). Uno ione
è un atomo che è diventato elettricamente carico dopo aver perso o acquisito elettroni.
Gli ioni complessi sono gruppi di atomi legati covalentemente che hanno acquisito una carica complessa
Esempio: NaCI. Na- un elettrone di valenza, Cl= 7 elettroni di valenza Na+ CI-.
I sali sono dei composti legati da un’attrazione elettrostatica tra anioni e cationi ovvero tra atomi carichi negativamente
e positivamente (esempio cloruro di sodio: NaCl). Quest’attrazione è molto forte allo stato solido perché gli atomi sono
molto vicini; tuttavia, in acqua viene meno perché gli atomi vengono allontanati: l’acqua è una molecola polare
(costituita da una parte carica positivamente e una negativamente), di conseguenza la parte con una carica positiva
attrae gli anioni e la parte negativamente carica attrae i cationi separandoli e determinandone la dissoluzione. I sali
possono essere costituiti da una combinazione di qualsiasi catione con qualsiasi anione, a condizione che vi sia un
equilibrio di cariche positive e negative. La combinazione di catione e anione che comunemente si può trovare che
causa la cristallizzazione del sale nelle pareti sono cloruro di sodio, solfato di sodio e solfato di calcio. Il solfato di
calcio è anche noto come gesso. Quando un sale si scioglie in acqua, si dissocia in ioni.
Per esempio, NaCl + H2O → Na++ Cl- Quando i composti formati dalla cristallizzazione di una soluzione possono
derivare dalla reazione di un acido (es. HCl) con una base (es. NaOH). HCl + NaOH → H2O + N++ Cl-Dopo++ Cl-
h2O -evaporazione→ NaCl Gli ioni che compongono questi sali possono essere di origine puramente naturale o
possono provenire da altri composti applicati deliberatamente a strade o muri. Possono provenire dalle sostanze
inquinanti nell’aria o nell’acqua.
I sali e l’ambiente
Vento ed esposizione al sole
Anche le condizioni di ventosità e di soleggiamento favoriscono la velocità di evaporazione dell’umidità e, quindi,
influiscono sull’innalzamento o sulla riduzione del livello dell’umidità di risalita. L’evaporazione unitaria aumenta da
tre a cinque volte sotto l’azione di un vento non eccessivamente forte, mentre da due a tre volte sotto l’azione del sole.
Evaporazione superficiale: il livello di innalzamento dell’acqua all’interno di una muratura umida è influenzato
principalmente dall’evaporazione superficiale del materiale, in una muratura che presenta umidità per capillarità in
condizioni di equilibrio (esempio: con altezza della macchia umida, stabilizzata a 50 cm dal suolo), la quantità di acqua
che viene assorbita dal terreno è uguale alla quantità di acqua che evapora dalle superfici della muratura stessa.
L’evaporazione superficiale dipende, però, dall’umidità relativa dell’aria e dalle dimensioni delle superfici della
muratura esposte all’aria. Ne consegue che il massimo livello di innalzamento è direttamente proporzionale all’umidità
atmosferica ed alla sezione assorbente, e inversamente proporzionale all’area di possibile evaporazione.
Temperatura e concentrazione salina
Anche la temperatura e la concentrazione di sali solubili disciolti nell’acqua di risalita condizionano la velocità e
l’intensità dell’assorbimento capillare. In particolare, questa aumenta poco col diminuire della temperatura, ma aumenta
di molto col crescere della concentrazione salina, a causa della marcata igroscopicità dei sali. I carbonati e i silicati
presenti nelle murature e nel terreno hanno un’elevata idrosolubilità, cioè diffondono le proprie molecole nell’acqua
attraverso un processo di disgregazione molecolare. Ne consegue che l’acqua, che dal terreno sale nelle murature, è
carica di sali disciolti che vengono trasportati durante la risalita capillare. Ma anche l’acqua dovuta a fenomeni di
condensazione superficiale o interstiziale, oppure quella di infiltrazione dovuta alle piogge, funge da solvente ed
attivatore oltre che da veicolo di trasporto dei sali solubili normalmente presenti in quanto elementi costituenti i
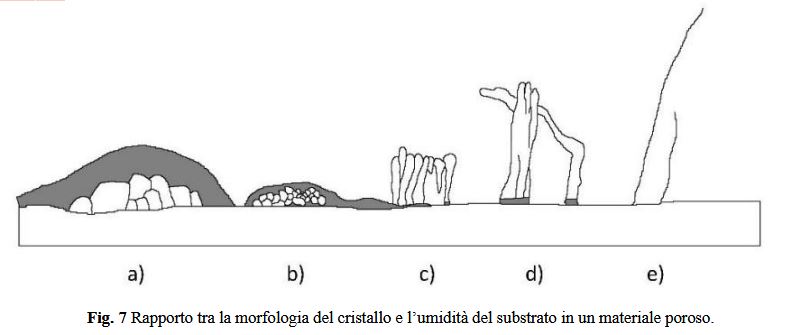
materiali da costruzione. In questo caso sono importanti due tipi di diagrammi: i diagrammi di solubilità dove la
concentrazione della soluzione tracciando una mappa con la temperatura (i confini di fase sono usati per rappresentare
la solubilità delle possibili fasi cristalline); e i diagrammi RH-temperatura che esprimono le condizioni ambientali nelle
quali il sale è stabile come una certa fase cristallina o come soluzione (i confini di fase rappresentano le transizioni tra le
possibili fasi). In questi grafici vengono inseriti per ragioni pratiche anche le condizioni di non-equilibrio dei Sali come
la solubilità delle forme metastabili e i confini di super saturazione.
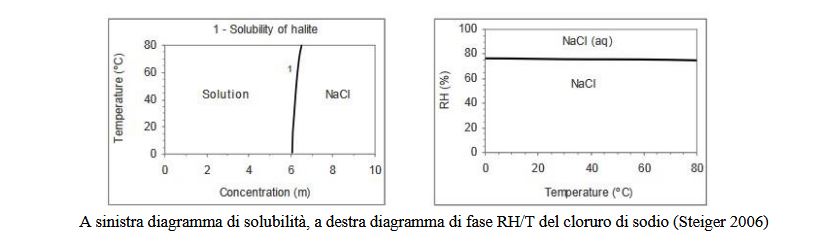
In una situazione di soluzione insatura non è possibile avere una cristallizzazione dei sali. Se a temperatura costante si
aumenta la concentrazione, il sale resta in soluzione fino al punto di saturazione. Per ogni ulteriore aumento di
concentrazione il sale in eccesso comincerà a cristallizzare e a precipitare spontaneamente. Questo può avvenire per
apporti successivi di sale o per evaporazione dell’acqua. La cristallizzazione può anche avvenire per cambiamenti di
temperatura a concentrazioni costanti nel caso di sali la cui solubilità varia con la temperatura. La cristallizzazione di
sali da una soluzione è costituita da due fasi principali. Nella prima fase, di nucleazione, si formano cristalli molto
piccoli, spesso casualmente. Questi nuclei fungono da germi di aggregazione ed aumentano di dimensioni durante la
successiva fase di crescita del cristallo. La nucleazione avviene più facilmente in presenza dei cosiddetti “germi” (ad
esempio particelle solide di polvere) che in soluzioni omogenee.
Il processo è tanto più aggressivo quanto più rapidi sono i cicli di umidificazione ed essiccazione del materiale. Le
murature possono essere interessate da molti tipi di sali solubili; data la complessità fisico-chimica delle sostanze usate
per la produzione dei materiali da costruzione e la varietà di possibili contaminazioni esterne con le quali la muratura
può venire a contatto, risulta quindi difficoltoso stabilire l’esatta provenienza di un sale anche per il fatto che la
posizione ove avviene la fioritura non è necessariamente quella ove ha avuto origine il fenomeno.

Tra le cause di apporto dei sali in una muratura non è da sottovalutare quella dovuta all’inquinamento atmosferico
prodotto dai gas di combustione degli impianti di riscaldamento e dai mezzi di trasposto. In generale gli effetti
dell’atmosfera inquinata da anidride carbonica, anidride solforosa ed ossidi di azoto accrescono la concentrazione ionica
della superficie dei paramenti murari, esaltando la solubilità di eventuali efflorescenze presenti. In particolare, la
presenza di calce negli intonaci e nei mattoni può combinarsi con i gas solforati dell’atmosfera urbana, dando luogo a
solfati di calcio che, dilavati dalle acque piovane, vengono assorbiti dalla muratura. Gli ossidi di azoto, combinati con
l’intervento di batteri, possono produrre nitrati di sodio e potassio deliquescenti. Nelle zone rurali, dove l’inquinamento
può essere causato da fertilizzanti a base di acido nitroso e nitrico, la contaminazione può avvenire non solo attraverso
l’assorbimento osmotico dal terreno, ma anche per condensa superficiale, con formazione di nitrati dagli effetti
dannosissimi.
Caso studio Luigi Massidda e Ulrico Sanna
Considerando sistemi aventi una porosità distribuita, caratterizzata cioè della presenza di differenti classi dimensionali,
risulta più appropriato utilizzare gli sviluppi di questa relazione secondo quanto proposto da Fitzner e Snethlage onde
considerare i contributi pesati delle differenti classi dimensionali:
Pr = g Pri Xri [3]
dove Xri = Vri /VR , e Vri il volume dei pori di dimensione ri, supposti connessi ai pori di dimensione R (di volume VR).
Un esempio emblematico della validità di questo approccio, è dato dal confronto fra due materiali che compongono
l’opus caementicium nel sito archeologico di Nora, un’importante
città portuale del periodo punico–romano nei pressi di Cagliari:
un’arenaria scarsamente cementata e quindi molto porosa, presente
sotto forma di conci di diversa pezzatura che costituisce
l’aggregato, e una malta di calce che rappresenta la fase legante di
questo “antico” calcestruzzo.
Questo sistema, sottoposto ad una forte aggressione da parte
dell’aerosol marino, manifesta pesanti segni di deterioramento
evidenti soprattutto per uno dei due materiali.
L’arenaria, pur essendo meccanicamente più debole dalla malta (le
resistenze a compressione sono rispettivamente pari a 3,2 MPa per
l’arenaria e 7,6 MPa per la malta, mentre la resistenza a trazione,
che rappresenta il parametro che in questo caso deve essere
considerato, può stimarsi pari a circa 1/10 di questi valori) appare
assai meno aggredita dai sali, nella fattispecie costituiti in
prevalenza da cloruro di sodio.
11
Le distribuzioni porosimmetriche relative ai due materiali messe a confronto nel grafico a lato (Distribuzione
dimensionale dei pori nella arenaria e nella malta nell’opus caementicium di Nora) permettono di spiegare questa
apparente anomalia.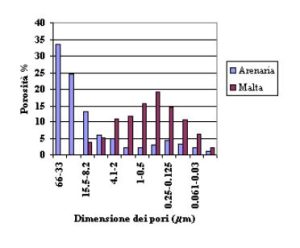
Le pressioni di cristallizzazione nell’arenaria calcolate tramite il modello di Fitzner e Snethlage sono risultate comprese
tra 1.0 e 4.0 MPa mentre i valori relativi alle malte di calce sono stati sempre superiori, talvolta anche di un ordine di
grandezza.
Le malte quindi, per quanto meccanicamente più resistenti, sono potenzialmente più aggredibili dell’arenaria la cui
struttura porosa, contenente in prevalenza pori di dimensione di qualche decina di mm, risulta in grado di “accomodare”
meglio i processi espansivi dovuti alla cristallizzazione dei Sali.
È proprio la distribuzione dei vuoti a rappresentare, quindi, il parametro critico per valutare la potenziale pericolosità di
un materiale sottoposto ad aggressione salina, in stretta analogia con i criteri di valutazione della sua gelività.
Il problema della cristallizzazione salina è però complicato da un ulteriore fattore. Alcuni sali infatti possono cambiare
formula, struttura cristallina e volume specifico in funzione della temperatura e dell’umidità relativa.
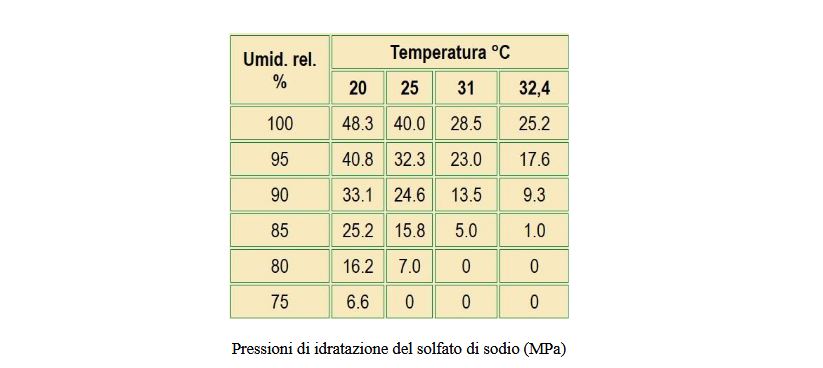
Il solfato di sodio, ad esempio, esiste in due forme stabili: una forma anidra Na2SO4), nota come Thenardite che
cristallizza ortorombica ed ha un volume molare pari a 53 cm3/mole, ed una decaidrata (Na2SO4.10H2O) che cristallizza
monoclina nota come Mirabilite di volume molare pari a 220 cm3/mole; esiste, inoltre, una forma metastabile con sette
molecole di acqua di cristallizzazione. A pressione atmosferica, la temperatura di transizione dalla forma anidra a quella
eptaidrata è di circa 23°C, mentre a quella della decaidrata è di 32°C, valori questi che nei climi temperati sono
facilmente attraversabili anche più volte nell’arco della stessa giornata.
Nella transizione Thenardite–Mirabilite si verifica un incremento di volume superiore al 300% con l’instaurarsi quindi
di elevatissime pressioni di idratazione (foto sotto), in determinate condizioni termoigrometriche, che provocano
sollecitazioni insopportabili per la maggior parte dei materiali da costruzione porosi.
Alla luce di tutte queste considerazioni, risulta estremamente difficile poter fare delle previsioni circa la durabilità di
una struttura soggetta ad aggressione per cristallizzazione salina anche se non è impossibile valutarne perlomeno la
pericolosità latente. Un’analisi dei sali solubili presenti, associata ad una accurata indagine porosi metrica dei materiali
insieme alle loro proprietà meccaniche, può rappresentare un indispensabile strumento per poter fare alcune ipotesi al
riguardo. Qualora queste indagini mettessero in evidenza pericolose presenze di sali bisognerà provvedere ad impedirne
un loro ulteriore ingresso e contemporaneamente evitarne pericolosi movimenti intercettando l’ingresso dell’acqua
attraverso barriere orizzontali, polimeri idrofobizzanti, coperture ecc. Una particolare attenzione deve essere, infine,
posta all’uso di consolidanti: infatti, a fronte di un sicuro miglioramento delle proprietà meccaniche si verificano
riduzioni della porosità che possono portare ad un peggioramento della durabilità quando i pori grandi, parzialmente
occlusi dal consolidante, vengono “trasformati” in pori di più piccola dimensione, con conseguenti maggiori pressioni di
cristallizzazione dei sali.
12
Un test fai da te per un calcolo approssimativo dei Sali presenti in una porzione di muratura possiamo farlo in questo
modo:
La determinazione ragionevolmente accurata dei solidi totali disciolti (TDS) può essere effettuata misurando la
conducibilità elettrica delle soluzioni dei campioni prelevati dalle pareti. L’attrezzatura richiesta include vasetti per
campioni, acqua deionizzata, un conduttimetro elettrico, una buona bilancia che leggerà fino a 0,1 grammi e un mortaio
e un pestello per abbattere i campioni in piccole dimensioni delle particelle. Un modo conveniente per ottenere il
conduttimetro e la soluzione di calibrazione associata e i contenitori per campioni è il “Salt Bag”. Sebbene il Salt Bag
sia destinato al monitoraggio della salinità dell’acqua e del suolo in agricoltura, può essere applicato anche al sale nei
muri. Utilizzando un trapano elettrico, raccogliere campioni da intervalli di profondità noti in una parete (vengono
comunemente testati 0– 10, 10-20 e 20-40 mm, anche se potrebbe essere necessario di più se ci sono sali più in
profondità nella parete). Se necessario, i campioni devono essere leggermente schiacciati con mortaio e pestello per
rompere eventuali grumi. Pesare 5 grammi di ogni campione e aggiungere a 50 ml di acqua deionizzata. Agitare bene e
lasciare che i sali si sciolgano per un po’. Misurare la conducibilità elettrica della soluzione. Con l’aiuto del calcolatore
di salinità del suolo e dell’acqua fornito nella sacca di sale, determinare il contenuto di sale della soluzione in parti per
milione. Moltiplicare il risultato per dieci per tenere conto della diluizione iniziale di dieci volte. Converti da parti per
milione a percentuale dividendo per 10.000.
Conclusioni
Sebbene oramai siano circa venti anni che mi occupo di risanamenti, rimango perplesso sia quando si propongono
soluzioni solo per i Sali e sia quando si propongono soluzioni solo per la risalita. Personalmente non ho mai proposto
solo una delle due soluzioni ma entrambi, semplicemente perché anche volendo risolvere solo la risalita i Sali presenti
nelle murature continuerebbero a lavorare con l’umidità relativa presente nell’aria, consiglio sempre una barriera alla
risalita, una barriera chimica o altri sistemi, se interviene con un taglio chimico subito dopo vanno demolite le malte se
la barriera è a micro emulsione (liquida), questo perché il prodotto iniettato all’interno della muratura smuoverà i Sali
portandoli in superficie durante l’evaporazione sia del prodotto stesso che dell’umidità residua all’interno della
muratura tenendo conto che nella vecchia malta erano già presenti Sali accumulati negli anni. Una volta demolite le
malte bisogna pensare ai Sali rimasti sulla e nella muratura, dopo spazzolare per rimuovere eventuali Sali ancora in
superficie e le parti incoerenti. Un sistema anti-salino in grado di impedire fisicamente l’idratazione dei sali da parte dei
nuovi intonaci durante la fase di applicazione e asciugatura degli stessi. Questo sistema impedirà ai Sali di idratarsi ma
allo stesso modo permetterà all’umidità residua di evaporare, una volta fatto questo una buona malta macro-porosa. Nel
caso si decidesse il risanamento con barriera chimica in gel stratigrafia o composizione della muratura permettendo la
demolizione andrà fatta prima per aiutare l’assorbimento della barriera in gel. Aumentando l’evaporazione aiuterà la
muratura nell’assorbimento del gel. Per il resto del procedimento si continua come nel primo caso. Prossimamente mi
impegnerò a ricercare e scrivere svariati rimedi nella gestione dei Sali nelle murature.
Riferimenti generali
• david Young per: Heritage Council of NSW · Heritage Victoria
• (Salt_attack_and_rising_damp)
• Cause e processo di cristallizzazione del sale (Harun, 2011)
• (Cigni, Codacci-Pisanelli, 1987)
• (Arch. Simona Lombardi)
• (Neretti, Soma, 1982).
• Cause e processo di cristallizzazione del sale (Harun, 2011)
• (Pinna, 1987)
• (Massari G., Massari I., 1992).
• “Manuale dei Materiali per l’Ingegneria” AIMAT, Ed. McGraw Hill Milano 1996
• D.H. Everett “The Thermodynamics of Frost Damage to Porous Solids” in Transactions fo the Faraday Society, vol. 57, 1961, pp 1541-
1551
• B. Fitzner, R. Snethlage, Über Zusammenhänge zwischen Salzkristallizationsdrunk und Porenradienverteilungd, GP News Letter, vol.3,
1982, pp 13-24
• Arnold A., Zehnder K., Salt weathering on monuments, in “La conservazione dei monumenti nel bacino mediterraneo: influenza
dell’ambiente costiero e dello spray marino sulla pietra calcarea e sul marmo”: atti del 1. Simposio internazionale, Bari 7-10 giugno 1989 /
editore scientifico Fulvio Zezza. – Brescia: Grafo, 520 p.: ill.; 26 cm, 1990
13
• The Conservation of Wall Paintings, Proceedings of a symposium organized by the Courtauld Institute of Art and the Getty Conservation
Institute, London, July 13-16, 1987 Sharon Cather, Editor
• (Luigi Massidda e Ulrico Sanna – Università di Cagliari)



